
原创|药品专利延长期限补偿之初探
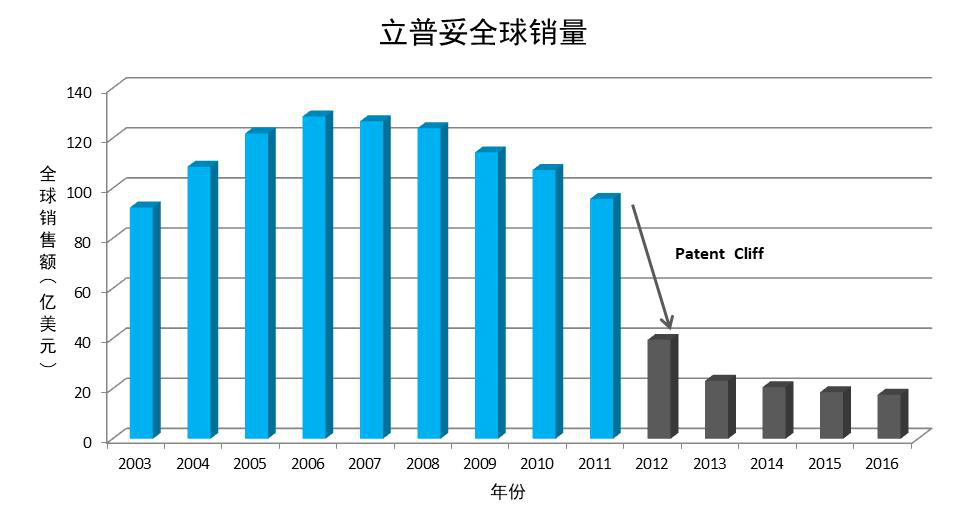
“立普妥”是全球最成功的畅销专利药物之一。辉瑞公司历年年报显示,该药物的销售峰值出现在2006年,销售额达到128.66亿美元。但在2011年前后随着全球专利陆续到期,遭遇专利悬崖(Patent Cliff),仿制药开始冲击市场,立普妥的销售额明显下滑,从2011年的95.7亿美元下滑至第二年的39.48亿美元,到2016年立普妥年销售额仅为17.58亿美元[1]。
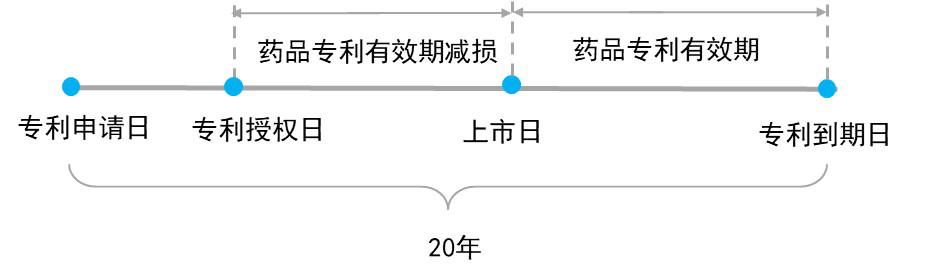
1984年,美国正式通过了《药品价格竞争和专利期恢复法》(即Hatch-Waxman 法案),率先建立起了药品专利延长制度以弥补临床试验、药品审批所造成的专利有效期减损,同时此项法案还确立了药品专利链接、并同时简化了仿制药的审批程序以平衡创新药公司与仿制药公司、社会公众三者之间的利益。
1992年,欧盟紧随其后通过了1768/92/EEC 建立了相应的药品专利延长制度-补充保护证书制度(Supplementary Protection Certificates)。
药品专利延长制度对于美、欧创新制药企业产生了非常重要的影响,其在专利到期后所提供的独占期往往是创新制药公司销售额的峰值时期。仍然以立普妥为例,其原全球专利应于2006年前后到期,而2006年正处于其销售额峰值期,通过药品专利延长制度,其全球专利直至2011年前后才陆续到期,而在2007-2011年立普妥又额外创造了568亿美元的销售收入。同样的礼来的氟西汀1986年在英国上市后,原专利于1995年到期,而其80%的销售额是在SPC补充保护的5年中获得的,而德国在同一时期由于没有SPC保护,其销售额明显下滑[2]。
为鼓励国内创新药企的发展,2020年10月17日,第十三届全国人民代表大会常务委员会第二十二次会议《关于修改〈中华人民共和国专利法〉的决定》第四次修正(以下简称新专利法)正式确立了专利延长制度,其中:
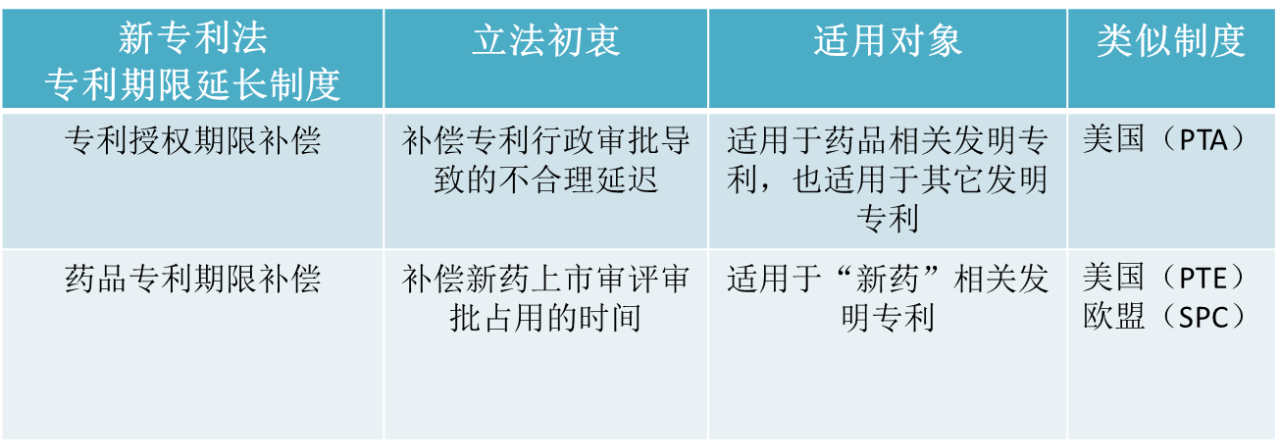
第四十二条第二款规定:“自发明专利申请日起满四年,且自实质审查请求之日起满三年后授予发明专利权的,国务院专利行政部门应专利权人的请求,就发明专利在授权过程中的不合理延迟给予专利权期限补偿,但由申请人引起的不合理延迟除外。”
第四十二条第三款规定:“为补偿新药上市审评审批占用的时间,对在中国获得上市许可的新药相关发明专利,国务院专利行政部门应专利权人的请求给予专利权期限补偿。补偿期限不超过五年,新药批准上市后总有效专利权期限不超过十四年。”
2020年11月27日,国家知识产权局公开发布《专利法实施细则修改建议(征求意见稿)》(以下简称实施细则修改建议)在专利法的框架下详尽规定了具体细节如专利延长期限的计算方法、提出申请的时机、申请条件、保护范围等。
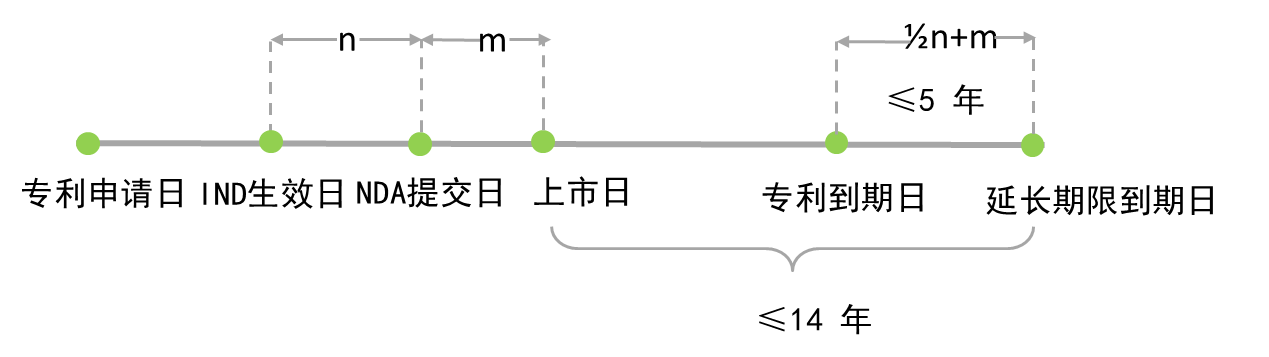
在本文中,由于篇幅所限,仅对药品专利期限补偿计算方法、保护范围两方面进行分析与讨论。为更好的理解新专利法、实施细则修改建议中对于上述制度的规定,笔者对中、美、欧三国药品专利期限补偿制度相应规定进行了比较。美国(35USC§156):
PTE(Patent term extension)=专利授权后有效临床试验阶段天数×1/2+NDA审批阶段天数,不超过5 年,且药品首次上市后剩余专利期加PTE不超过14 年。
欧盟(469/2009/EC):
SPC(Supplementary Protection Certificates)=首次上市许可的日期-基本专利申请日期-5年,SPC不得超过5 年,且药品首次被批准上市时的剩余专利期加SPC 期限不得超过15 年。
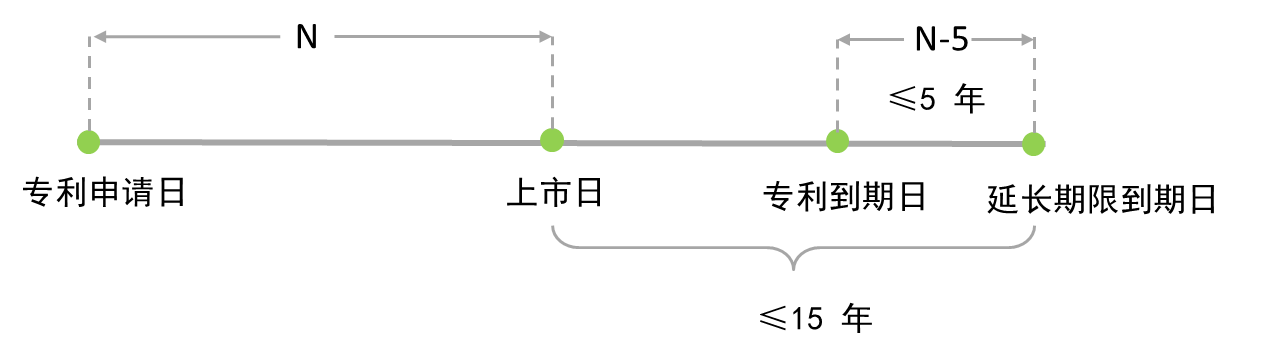
药品专利期限补偿时间的计算方式为申请注册的新药在中国首次获得上市许可之日减去专利申请日,再减去5年,补偿期限不超过五年,新药批准上市后总有效专利权期限不超过十四年。
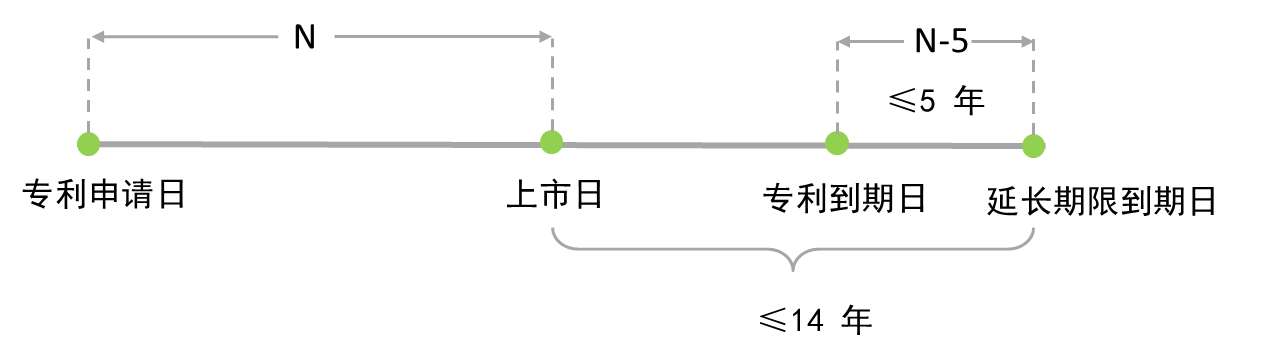
美国、欧盟所采用的专利延长期限的计算方法具有一定差异。从美国的算法中能够清晰的看出立法者的立法意图,即补偿因药品审批所导致的有效专利期减损。在欧盟算法中,仅对专利申请日5年后才批准上市的药物提供补充保护,即对于已经具有足够有效专利期限回收成本的药品不予补充保护,该算法也同样能够反映出相应的立法目的。
在美国算法中涉及到专利授权时间、临床试验时间、药品审批时间、申请人未尽义务时间等多个变量,计算相对繁琐与复杂,在实际操作过程中需要FDA(美国食品和药品监督管理局)与USPTO(美国专利与商标局)多轮联动,FDA要帮助USPTO判定某产品的专利期限补偿资格,向后者提供上述产品的法律审查期限方面的信息;FDA听从后者就专利是否符合PTE条件的意见,USPTO根据FDA提供的期限信息计算PTE并颁发专利保护期延长证书[3]。在欧洲算法中涉及专利申请日与上市日两个变量,计算方法中时间点较为明确,计算较为简单,申请人仅需向欧洲国家专利局提供专利申请文本、上市许可证书,专利局即可确定延长期限。
实施细则修改建议中的计算方法则兼容并包、纳百家之长,一方面吸收了欧盟的相对简单的计算方式,揣测立法者可能考虑到行政效率以及行政资源配置,采用上述简便的计算方式有利于整个制度的推进与施行。另一方面上市后总有效专利期限上限则参考了美国,相对于欧洲减少了1年。欧盟地区秉承创新药专利强保护策略,而美国则在鼓励创新药研发的同时,也兼顾了仿制药的发展进步,笔者揣测上述上限则更多考虑到了国内目前仿制药、创新药发展的大环境。中国(实施细则修改建议第新增第八十五条之六)
药品专利期限补偿期间,该专利的保护范围限于国务院药品监督管理部门批准上市的新药,且限于该新药经批准的适应症。
美国(35 U.S.C.156(b))
(1)对于产品专利,应被限定于依据监管审查期所依据的法律规定所确定的用途;
(2)对于产品的使用方法专利,应限定于专利请求保护并且获批的用途;
(3)对于产品的制备方法专利,应限定于制备获批产品的方法[4]。
欧盟(469/2009/EC Article 4)
在基本专利所赋予的保护范围内,在证书到期之前,补充保护证书授予的保护应仅延及于将相应药品投放市场的授权书所涵盖的产品;以及获得许可的作为药品的该产品的任意用途[5]。
从美国、欧盟和我国的立法来看,无一例外地对延期后的专利保护范围作出了严格的限定。药品专利期限补偿期间的保护范围并非原专利权的直接延伸,主要体现在延期后的专利保护范围不再是以原专利的权利要求书为准,而是在原专利保护范围的基础上将其进一步限缩至获批用途的上市药品。
专利法实施细则虽目前仍处于修订过程中,但目前的规定已能够反映出立法者总体意图。因而有必要对目前的药品专利延长期限计算方法进行分析,未雨绸缪,为即将施行的专利延长制度做好充分的准备。
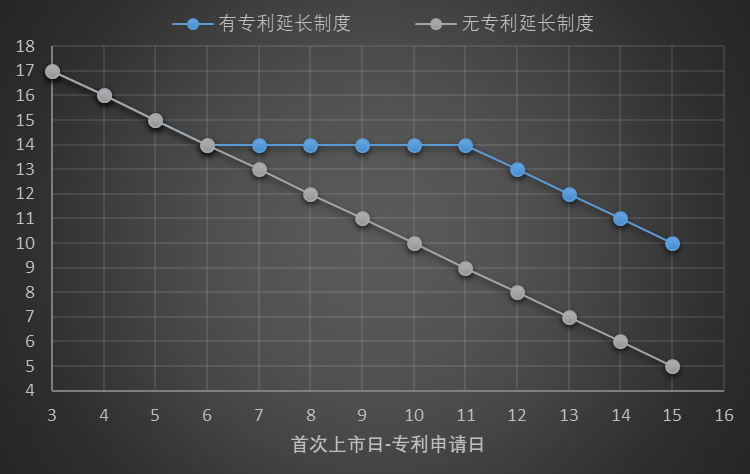
由图可知,在没有药品专利延长制度的情形下,随着药物研发、审批的耗时增加,专利有效保护期逐渐衰减。当存在药品专利延长制度的情况下,随着药物研发、审批的耗时增加,专利有效期仍然处于衰减状态,但药品专利延长制度提供了一个14年有效专利保护期限的缓冲平台期,即从药品专利申请至药品上市之日6-11年内,均能获得14年有效专利保护期,其药品专利延长期限也从0递增至5年。从第11年开始,虽均能享受最长5年的补充保护期,但总的有效专利保护期已低于14年。
总的来说,如果申请日至上市日所消耗时间大于6年,则意味需要启动专利延长程序,虽然总有效专利期限得以延长,但其中包含了0-5年范围缩减的专利补充保护期。
对于创新药企业而言,如果能在专利申请日起不超过5年内实现药品上市,则无需启动专利延长程序,其享受的专利有效保护期为最长,而且其保护范围由授权的权利要求文本决定,并不仅限于上市的特定适应症的新药,在保护自身产品的同时也可以防止其他企业进行微小改动突破专利壁垒,此种情形下无疑对于企业是最有利的。但实际情况下由于同一赛道竞争激烈,药物开发进展、审批进度缓慢等因素,实现上述理想情形较为困难。因此,创新药企业应当充分、综合评估信息公开、研发进展、竞争情况等因素,合理确定专利申请时间,充分利用药品专利延长制度提供的平台期,以确保能够最大化的享受有效专利保护期。
另外,新专利法中规定了专利延长适用请求原则,即需要创新药企密切监测时限,及时、主动向国家知识产权局申请专利授权期限补偿和药品专利期限补偿。同时应密切关注相关法律动态,积极向立法部门反映自身诉求,推动配套规定的完善,并基于目前的草案做好充分研究、准备,以应对即将施行的药品专利制度。
注释:
[1]《药品专利链接与专利延长》 国家知识产权局专利局专利审查协作江苏中心编 2020
[2]欧盟药品补充保护证书(SPC)制度简介,唐晓帆,《电子知识产权》,第42-45页,2005.10.
[3]美国专利保护期延长制度管窥(一),寇飞,知产力微信公众号,2020年12月3日。
[4] (1) in the case of a patent which claims a product, be limited to any use approved for the product;
(2) in the case of a patent which claims a method of using a product, be limited to any use claimed by the patent and approved for the product;
(3) in the case of a patent which claims a method of manufacturing a product, be limited to the method of manufacturing as used to make the approved product.
[5]Within the limits of the protection conferred by the basic patent, the protection conferred by a certificate shall extend only to the product covered by the authorisation to place the corresponding medicinal product on the market and for any use of the product as a medicinal product that has been authorized before the expiry of the certificate.
编辑:肖晋
作者:董潜

相关文章
|
关注公众号
|
联系小编
|
|
| 电话:+86 18917798290 | ||
| 地址:上海市嘉定区陈家山路355号创新创业大厦 | ||


 分享到微博
分享到微博 分享到微信
分享到微信 分享到领英
分享到领英
