
下篇 | 生物仿制药业2020年度回顾报告

生物仿制药2020年度回顾
01. 2020 年生物仿制药的批准和上市情况
02. 生物仿制药最新监管资讯
03. 与生物制品和生物仿制药相关的立法
04. BPCIA 诉讼
05. 反垄断诉讼
06. 专利审判与上诉委员会 (PTAB) 受理的授权后挑战
07. 结语
BPCIA 诉讼
下面,我们简要总结了迄今为止有关 BPCIA 地区法院诉讼的总体统计数据,并在后续章节中回顾 (A) 待决的 BPCIA 地区法院案件,(B) 2020 年达成和解的 BPCIA 地区法院案件,以及 (C) 最新裁决的 BPCIA 上诉案件。我们还将介绍一些涉及生物制品和生物仿制药的其他联邦巡回法院上诉案件。
自 2010 年颁布 BPCIA 以来,地区法院收到了超过 45 项 BPCIA 案件[7](参见图 2)。Amgen(16 项案件)和Genentech(15 项案件)是最活跃的原告,这两家公司在所有BPCIA 诉讼的原告方中共占了超过半数。Amgen 同时也是最常见的BPCIA 被告(8 项案件),Celltrion(7 项案件)和山德士(6 项案件)紧随其后。
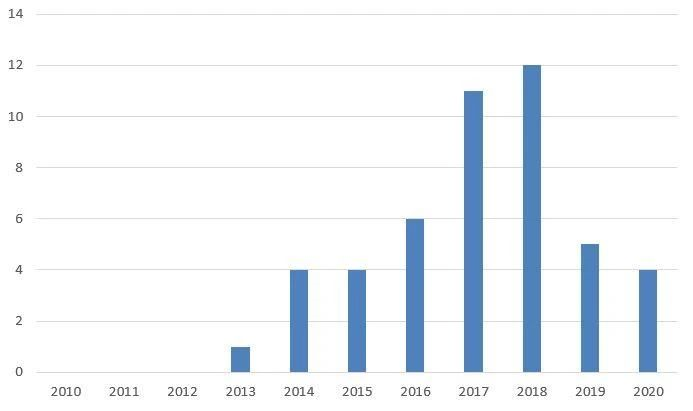 图 2. 自 BPCIA 颁布以来按年统计的BPCIA 诉讼提交量
图 2. 自 BPCIA 颁布以来按年统计的BPCIA 诉讼提交量
BPCIA 诉讼已涉及以下九种不同参比产品的生物仿制药:Remicade®、Neulasta®、Neupogen®、Avastin®、Herceptin®、Rituxan®、Humira®、Enbrel® 和 Epogen®。毫不奇怪的是,这些也正是 FDA 已批准生物仿制药的九种参比产品(参见上文第 I 节)。
2019 年,BPCIA地区法院诉讼量开始下降,2020 年继续保持了这一趋势。(参见图 2。)2018 年达到创纪录的 12 项BPCIA 地区法院诉讼,而 2019 年的这一数量为 5 项,到了 2020 年则仅有 4 项。现在,让我们来逐一看看这4 项新案件,以及近期的其他诉讼活动。
1) 待决的 BPCIA 地区法院诉讼
2020 年提起的四项BPCIA 诉讼(参见表 4)目前正在审理中。
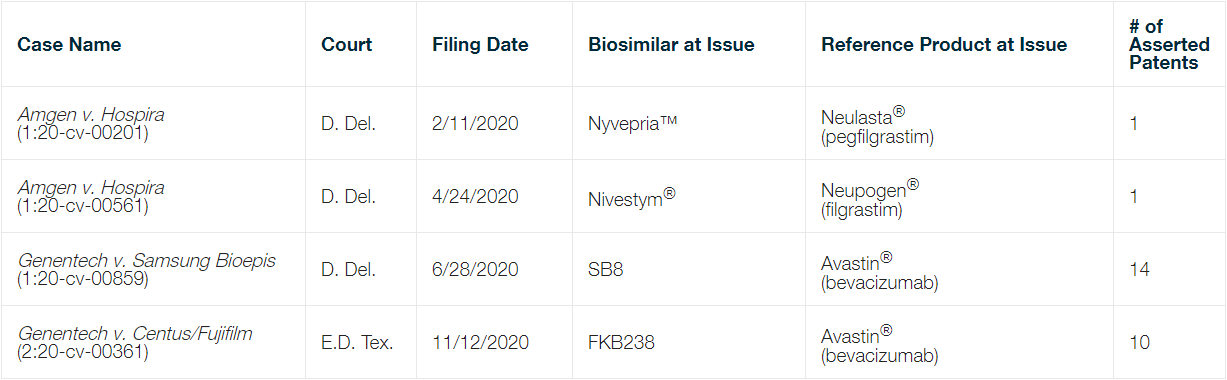
此外,还有两项提交于 2020 年前的案件也仍在审理:
Amgen 诉 Hospira 案(18-cv-01064,特拉华州地区法院);Neupogen®/Nivestym®
Immunex 诉 Samsung Bioepis 案(19-cv-11755,新泽西联邦地区法院);Enbrel®/Eticovo™
下面分别简要介绍了待决的各项 BPCIA 地区法院诉讼案件。
Amgen 诉 Hospira 案(20-cv-00201,特拉华州地区法院)
此案涉及 Hospira 针对 Amgen 的 Neulasta®(培非格司亭)所生产的生物仿制药。Amgen 于 2020 年 2 月 11 日提起针对Hospira 和辉瑞的诉讼,指控两者侵犯第 8,273,707 号美国专利(’707专利),该专利主张需一定浓度的特定盐组合物的蛋白质纯化方法。(案卷 1 第2 页、10-12 页。)Amgen 此前曾分别在 BPCIA 诉讼中针对另外两家生物仿制药开发商Coherus 和 Mylan 主张该专利,这两个案件都已于2019 年结案。特拉华州地区法院基于专利审查过程禁止反言原则驳回了 Coherus 案,从而禁止 Amgen 根据等同原则对不同于 ’707 专利权利要求的盐组合物主张侵权,联邦巡回法院在上诉案中作出维持原判的裁定。Amgen 诉Coherus 案,17-cv-00546,2018WL 1517689,第 *1 页(特拉华州地区法院,2018年 3 月 26 日),维持原判,931F.3d 1154(联邦巡回法院,2019 年)。在 Coherus 案裁决后不久,Mylan案(17-1235,宾夕法尼亚西区联邦地区法院)的当事双方经协商约定为未侵权。
而在此案中,Hospira 和辉瑞提出撤诉动议,称不存在字面侵权,其理由是 (1) 被指控的工艺所用的盐浓度低于 ’707专利中主张的浓度(根据专利审查过程中提出的免责声明进行适当解释),并且 (2) 根据专利审查过程禁止反言原则,Amgen 不能出于与 Coherus 案相同的理由,根据等同原则指控不同浓度的盐组合物存在侵权。(案卷 19 第1-4 页。)Amgen 提出对立意见,称 Coherus 案的裁决“基于的是所用盐的特性而非浓度”。(案卷28 第 1-2、6 页。)Amgen 还指出,由于存在未决的权利要求解释和事实问题,例如“有关0.1M”的权利要求解释,在答辩阶段作出非侵权裁定还为时过早。(同上,第 4 页。)辉瑞在回复中反驳了Amgen 的观点。(参见案卷31。)
撤诉动议处于待决状态,当事各方目前正在进行事实证据开示和权利要求解释陈述。陪审团审理定于 2022 年 7 月 11 日举行。(案卷 33。)
Amgen 诉 Hospira 案(20-cv-00561,特拉华州地区法院)
此案涉及针对 Amgen 的 Neupogen®(非格司亭)所生产的生物仿制药,属于在特拉华州地区法院审理的相同当事方之间待决案件(18-cv-01064,参见下文)的跟进诉讼。此案涉及一项新发布的专利(即第 10,577,392 号美国专利),该专利针对相同的Neupogen® 生物仿制药。(案卷 1 第3 页。)’392 专利针对的是“生物制品制造过程中使用的蛋白质纯化方法”。(同上。)Amgen 在诉状中指出,其根据《美国法典》第 42 编第262(l)(7) 条提供按照第 262(l)(3)(A)条所列专利清单的补充信息,及时披露了 ’392 专利。(同上,第 3、12、18 页。)Amgen指控 Hospira 和辉瑞未遵守第 262(l)(7) 条,因为它们未在 Amgen 提供补充信息后 30 天内向 Amgen 提供“基于第 (3)(B) 条的声明……”,并且截至诉状提交之日,Hospira 和辉瑞仍未提供第(3)(B) 条规定的声明。(同上,第18 页。)
2020 年6 月 24 日,法院发布了口头命令,否决了 Amgen 所提将此案与未决的 2018 年案件合并的动议。法院指出不会“在未经被告同意的情况下将此案与任何其他诉讼合并”。法院解释道:
原告于 2018 年 7 月 18 日提起18-1064 号诉讼。而直到 2020 年 4 月 24 日,原告才提起此诉讼。如果当事方同意在合并案件中使用18-1064 号案件中聘用的专家,被告将合理同意合并这两个案件。但是,原告拒绝同意该要求,因此,原告应承担在提起18-1064 号诉讼近两年后单独提起此诉讼的后果。
2021 年1 月 7 日,法院批准了 Hospira 和辉瑞的部分动议,在未决的 2018 年案件结案之前暂停审理此案。(案卷 30。)法院批准暂停审理的原因是:(1) 这两个案件涉及“相同的当事方,相同的被指控侵权行为,相同的被指控工艺,并且相关专利……存在重叠的权利要求条款”,因此,暂停审理“将很可能简化所涉问题和案件审理”;(2)事实证据开示尚未开始,且此案尚未确定审理日期,而 2018 年案件已预定于2021 年 5 月 17 日开始进行陪审团审理;并且(3)“暂停审理既不会给 Amgen 造成不当损害,也不会为Amgen 带来明确的战术优势”。(同上,第3-4 页。)法院指出,如果 Amgen 声称“被告‘有明确意图将Nivestym® 的定价设为低于其他竞争对手,这可能损害 [Amgen] 的利益’”,则可在未决的 2018 年案件中就任何价格侵蚀寻求救济,因为这两个案件涉及相同的被指控侵权行为和被指控工艺。(同上,第 5 页。)虽然批准了暂停审理的动议,但法院驳回了 Hospira 和辉瑞“寻求在包括所有上诉的C.A. 18-1064 案达成最终解决之前暂停审理”的动议。(同上。)
Genentech 诉 Samsung Bioepis 案(20-cv-00859,特拉华州地区法院)
此案所涉事由是 SamsungBioepis 拟针对 Genentech 的 Avastin®(贝伐单抗)生产生物仿制药。Samsung Bioepis 是Genentech 提起 BPCIA 诉讼的第三家贝伐单抗生物仿制药开发商,在此之前,Genentech已针对辉瑞和 Amgen 提起诉讼,这两项案件分别于 2019年和 2020 年达成和解。Amgen 案(17-cv-01407,17-cv-01471,19-cv-00602,特拉华州地区法院)将在下文中介绍。
2020 年6 月 28 日,Genentech 提交了针对 Samsung Bioepis 的诉状,指控其侵犯 14 项专利,这些专利涵盖制造贝伐单抗的方法以及使用贝伐单抗治疗患者的方法。(案卷 1。)Genentech还指控 Samsung Bioepis 的“专利舞蹈”交流基于若干原因而不充分,例如未根据第262(l)(2)(A)条的要求提供 Samsung Bioepis SB8 产品的“其他制造信息”,以及未根据第262(l)(3)(B)条的要求提供“详细声明,来根据具体权利要求说明其意见的事实和法律依据……以表明 [Genentech 指定的专利] 无效、不可执行或不会因商业营销而遭到侵权”。(同上,第 6-7 页。)
Samsung Bioepis 于 2020 年 8 月31 日进行答辩并提出反诉,包括针对无效性等方面的积极抗辩,以及针对非侵权和无效性的反诉。(案卷9。)Samsung Bioepis 还指控“专利舞蹈”存在违规行为,例如Genentech 根据第 (l)(7) 条补充专利清单,但随后在Samsung Bioepis 提供关于非侵权、无效性和不可执行性的声明之前提起诉讼。(同上,第 59 页。)
2020 年9 月 21 日,Genentech 提交了驳回 Samsung Bioepis 反诉和第三次积极抗辩的动议,指出Samsung Bioepis 不能寻求其未在“专利舞蹈”披露中提出的专利无效性主张。(案卷 12 第 1 页。)对于 Genentech 提交的支持其动议并反对Samsung Bioepis 的文件,双方就法院在 Genentech 诉 Amgen 案(17-cv-01407,2020 WL 636439,第 *4-5 页,特拉华州地区法院,2020 年 2 月 11 日,参见下文)中所作裁决的范围和含义产生争议,法院在该裁决中指出,Amgen并不受限于其在“专利舞蹈”中提出的无效性立场。例如,Genentech 声称,在缺乏充分理由的情况下,生物仿制药不能扩展其无效性理论,并且如未在“专利舞蹈”中提出无效性论证,可导致“权利丧失”。(案卷12 第 5 页。)
法院尚未对该撤诉动议作出裁定。陪审团审理定于 2023 年 7 月 10 日举行。
Genentech 诉 Centus/富士胶片案(20-cv-00361,德克萨斯东区联邦地区法院)
这是在德克萨斯东区提起的首项 BPCIA 诉讼,也是涉及 Centus 及其共同被告 Fujifilm KyowaKirin Biologics co., Ltd.、富士胶片和 Kyowa Kirin co., Ltd. 的首项 BPCIA 诉讼。此案涉及 Centus 拟参照 Genentech 的 Avastin®(贝伐单抗)生产生物仿制药 FKB238。Centus 是 Genentech 提起 BPCIA 诉讼的第四家贝伐单抗生物仿制药开发商,在此之前,基因泰克已分别针对辉瑞、Amgen 和Samsung Bioepis 提起了诉讼。
2020 年11 月 12 日,Genentech 提交了一份诉状,声称其 10 项专利受到侵犯,这些专利涵盖制造贝伐单抗的方法以及使用贝伐单抗治疗患者的方法。(案卷1。)Genentech 还指控 Centus 违反 BPCIA 关于“专利舞蹈”的某些规定。例如,Genentech 声称 Centus 未按照《美国法典》第 42 编第 262(l)(2)(A)条的要求提供“其他信息,以说明用于制造作为此等申请标的的生物制品的工艺”。(同上,第 6-7 页。)Genentech 还声称 Centus 的“详细”无效性声明“仅提供了推断性的断言来称 Genentech 根据……第262(l)(3)(A)条指定的专利无效”。(同上,第7-8 页。)
Centus 尚未对Genentech 的起诉作出回应。
Amgen 诉 Hospira 案(18-cv-01064,特拉华州地区法院)
此案涉及 Nivestym®,这是 Hospira 和辉瑞针对 Amgen 的 Neupogen®(非格司亭)所生产的生物仿制药。Amgen指控 Hospira 侵犯了一项专利(即第 9,643,997号美国专利),该专利专门针对蛋白质纯化。(案卷 1 第 3 页。)
当事各方目前正就 Hospira 和辉瑞的销售阻却和公共用途抗辩进行补充专家调查,法院今年已对因这些问题产生的两项证据开示争议作出了裁决。陪审团审理预定于2021 年 5 月 17 日举行。(案卷152。)
Immunex 诉 Samsung Bioepis 案(19-cv-11755,新泽西联邦地区法院)
此案涉及 SamsungBioepis 参照 Immunex 的 Enbrel®(依那西普)所生产的生物仿制药 Eticovo™。Immunex 指控Samsung Bioepis 侵犯五项专利。(案卷 1 第3 页。)这些专利与指控山德士侵犯所涉的专利相重叠,联邦巡回法院最近确认,山德士未能证明其中两项专利无效或不可执行,具体参见下文(CAFC 20-1037)。
2020 年1 月 8 日,法院下达了一项同意禁令,禁止 SamsungBioepis 在美国制造、使用、进口、要约销售或销售“Bioepis 的依那西普产品或包含称为依那西普的融合蛋白的任何其他产品,但《美国法典》第35 编第 271(e)(1) 条‘安全港条款’允许的情况除外”。(案卷 113第 1 页。)该命令的依据是“2019 年 12 月 23 日向法院提交的协议书,D.I.105”,该协议书已封存,不予公开。(同上。)
2020 年1 月 15 日,法院下达命令,指出此案应根据上述已封存的协议书暂缓行政审理。(案卷116。)在 2020 年的剩余时间里,此案一直暂缓行政审理。
2)2020 年达成和解或结案的BPCIA 诉讼
2020 年达成和解或结案的BPCIA 案件包括:
Genentech 诉 Amgen 案(17-cv-01407,17-cv-01471,19-cv-00602,特拉华州地区法院);Avastin®/Mvasi™
Genentech 诉 Amgen 案(18-cv-00924,特拉华州地区法院);Herceptin®/Kanjinti™
Amgen 诉 Coherus 案(17-cv-00546,特拉华州地区法院);Neulasta®/Udenyca®
下面,我们将分别简要介绍这些已结案的案件。
Genentech 诉 Amgen 案(17-cv-01407、-01471,19-cv-00602,特拉华州地区法院)
这一系列合并案件涉及 Amgen 拟生产的Avastin®(贝伐单抗)生物仿制药,此等案件已在 2020 年 7 月达成和解。2020 年7 月 7 日,当事各方提交了一份联合撤诉协议书,声称已经达成和解协议,共同约定自愿主动撤销所有权利要求和反诉,且不保留再诉权利。(案卷691。)
在和解之前,地区法院于 2020 年发布了若干可能适用于其他生物仿制药诉讼的规定。例如,2020 年 3 月,法院任命了一名法学教授作为特别主事人,负责处理此案和相关 Herceptin® 案件(18-cv-00924,参见下文)中各方对各种法院备案文件的封存请求。(参见17-cv-01407,案卷 659。)法院批准的报告和建议确认,当事方“有合法理由”根据BPCIA 编辑“反映当事方在非公开审前交流中进行实质性交流的敏感和保密诉前材料”,以及其他敏感材料。(17-cv-01407,案卷 694 第 11-12 页。)在批准当事方的编辑材料时,特别主事人进一步确认,在“竞争激烈的制药业环境中,即使是看似微不足道的制药公司信息,对于竞争对手可能也很有价值”。(同上,第14 页。)
法院还处理了关于生物仿制药诉讼当事人是否受限于其“专利舞蹈”交流的第一印象问题。在此案中,Genentech 基于 Amgen 所提参照Genentech Avastin® 生产的 Mvasi™ 生物仿制药 BLA 主张了26 项专利。(参见 17-cv-01407,案卷 626第 1 页第 1 项。)Amgen提交了反诉和积极抗辩,声称所有涉案专利均无效且/或不可执行。(17-cv-01407,案卷 124。)随后,Genentech 基于 Amgen 未遵守 BPCIA 规定的“专利舞蹈”程序,提出驳回Amgen 反诉和积极抗辩的动议。(17-cv-01407,案卷 128,案卷 129。)对于 Amgen 的宣告式判决反诉,Genentech声称这受到《美国法典》第 42 编第 262(l)(9)(C)条的禁止,因为 Amgen 未在“专利舞蹈”期间提供充分信息来说明其制造工艺,且BPCIA 禁止不遵守第 (2)(A) 小节“专利舞蹈”规定的生物仿制药为获得宣告性救济而“提起诉讼”。(17-cv-01407,案卷 129 第 2-4 页。)Genentech还声称,Amgen 在无效性反诉和积极抗辩中所作的抗辩“如果是基于Amgen 并未根据第 262(l)(3)(B) 条在‘专利舞蹈’中向Genentech 披露的无效性、不可执行性和非侵权性论点,则这些抗辩是被 BPCIA 禁止的”。(17-cv-01407,案卷 626 第 8 页;另请参见案卷 129 第 5-9 页。)
2020 年 2 月 11 日,法院驳回了 Genentech 的撤诉动议。(17-cv-01407,案卷626。)法院认为,“提交反诉并不构成‘提起诉讼’,因此不应受到第262(l)(9)(C) 条的禁止”。(同上,第 9 页。)因此,如果生物仿制药申请人未遵守“专利舞蹈”规定或者选择不参与“专利舞蹈”,并不会导致禁止该申请人提起无效性或非侵权反诉。(同上,第12–13 页。)法院还裁定,不得禁止生物仿制药申请人提出未在“专利舞蹈”过程中披露的抗辩。(同上。)法院认为,Genentech没有“指出 BPCIA 或解释 BPCIA 的判例法中有任何规定支持禁止生物仿制药申请人提出未在‘专利舞蹈’中披露的 BPCIA 案件论点”。(同上,第10 页。)Genentech 的论据也受到第 262(l)(9)(B)条规定以及最高法院在山德士案中的裁决的否定,最高法院在该案中认定,第 262(l)(9)(B)和 (9)(C) 条的救济规定属于“排他性救济”。(同上,第10-12 页。)最后,对于在其第 (3)(B) 条声明中指控的Amgen 不合规行为,Genentech 可获得的“唯一救济”是“对拟制侵权提起宣告式判决诉讼”,而Genentech 已经提起了此等诉讼。(同上,第 12 页。)如上文所述,Genentech和 Samsung Bioepis 目前对此裁决的范围存在争议,因为此裁决涉及先前未在“专利舞蹈”中提出的无效性理论。
Genentech 诉 Amgen 案(18-cv-00924,特拉华州地区法院)
此案涉及 Amgen 的Kanjinti™,这是 GenentechHerceptin®(曲妥珠单抗)的生物仿制药,此案也在 2020 年 7 月达成和解。(案卷 555。)
在和解之前,2020 年2 月,法院驳回了 Genentech 所提驳回 Amgen 关于不当发明/衍生以及“不洁之手”/不公平行为的积极抗辩和相关反诉的动议,此等抗辩和反诉是为回应Genentech 第三次修订诉状而增提的。(案卷 442 和507。)Genentech 声称,其仅对诉状进行了部分修订,“以应对Amgen 7 月推出 Herceptin 生物仿制产品”,并且这些新的抗辩和反诉是打了时程命令的擦边球。(案卷442 第 1 页。)尽管如此,法院认为,“Amgen提交了一份回应答辩状,以此有权提起新的反诉,而无需考虑 Genentech 修订诉状的范围”。(案卷507 第 2 页。)法院指出,Genentech“对于 Amgen 所提目前被 Genentech 反对的抗辩和反诉只能责怪自己”,并且“Genentech 决定修订其诉状是为Amgen 提起反诉打开了大门”。(同上,第 3 页。)
Amgen 诉 Coherus 案(17-cv-00546,特拉华州地区法院)
此案涉及 Coherus 参照Amgen 的 Neulasta®(培非格司亭)所生产的生物仿制药Udenyca®。Amgen 声称其蛋白质纯化专利(第8,273,707 号美国专利)根据等同原则遭到侵权。(案卷 1 第2-3 页、9-11 页。)地区法院驳回了该起诉,且联邦巡回法院维持原判,称Amgen 的权利要求受到专利审查过程禁止反言原则的禁止。参见 Amgen 诉 Coherus 案,编号 17-cv-00546,2018 WL 1517689,第 *2-3 页(特拉华州地区法院,2018 年 3 月26 日),Amgen 诉 Coherus 案,931 F.3d 1154, 1156(联邦巡回法院,2019 年)。
2019 年 10 月,Coherus提出动议进行律师费索偿。(案卷 92。)Coherus 声称,此案出于多种原因而属于特殊情况,其中包括 Amgen 侵权案件的薄弱立场以及Amgen 坚持一直上诉。(案卷 92 第 6-11 页;案卷 97。)2020 年11 月 30 日,法院驳回了 Coherus 有关律师费索偿的动议。(案卷 98。)法院认为,尽管此案基于规则12(b)(6) 动议被驳回,但是“Amgen 的诉讼立场并非异常薄弱”;“Amgen在‘专利舞蹈’期间的行为并不构成对该机制的滥用”;并且“没有证据表明 Amgen 恶意寻求上诉(其有权寻求上诉)”,特别是联邦巡回法院在举行口头听证后,称其裁决“是有先例的”。(同上,第4-5、7-8 页。)
其他地区法院诉讼——Coherus 诉 Amgen 案(19-cv-00139,特拉华州地区法院)
首项生物仿制药对生物仿制药的案件(即 Coherus 诉 Amgen 案)于 2019 年提起并被驳回。此案涉及均以艾伯维的 Humira®(阿达木单抗)作为参比产品生产的两种生物仿制药:Coherus 的CHS-1420 和 Amgen 的 Amjevita™。Coherus 指控 Amgen 侵犯其四项配方专利,其理由是 Amgen“在整个欧洲积极进行 Amjevita™ 的要约销售和销售”,并且“在美国积极制造 Amjevita™ 以在欧洲销售”。(案卷 7 第 4-5 页。)2019 年11 月,当事双方经协商同意撤销此案。(案卷 52。)
2019 年 12 月,Amgen提出了关于根据《美国法典》第 35 编第 285 条宣告此案属于特殊情况并进行律师费索偿的动议。(案卷 55。)Amgen 声称 Coherus“在 2019 年6 月 5 日(此时 Coherus 已知晓或应合理知晓其侵权申索毫无依据)至 2019 年 10 月 17 日(此时 Coherus 首次告知Amgen 其打算撤诉)期间错误地持续维持此诉讼”。(案卷 59 第1 页。)
2020 年 6 月 11 日,法院驳回了 Amgen 要求律师费索偿的动议,认为“Coherus 在相关时期关于 Amgen 第 273 条抗辩的立场不合理程度并不导致根据第285 条确定此属于特殊案件”,并且“Coherus 在2019 年 6 月 5 日至2019 年 10 月 17 日期间持续维持诉讼,并不导致认定此属于特殊案件”。(案卷 72 第11-12 页。)法院指出,“Amgen 认为 Coherus花费了不必要的时间来评估 Amgen 先用权抗辩的案情实质,而案件记录并不支持Amgen 的这一立场”,并且“案件记录还反映,在 Coherus 评估先用权抗辩的案情实质时,Amgen激进的诉讼策略导致其费用增加”。(同上,第 12 页。)
3) 2020 年驳回的 BPCIA 联邦巡回法院上诉案件
2020 年,联邦巡回法院对多起 BPCIA 案件作出了裁决,我们将在下文论述这些裁决。到2020 年底,联邦巡回法院已没有待决的 BPCIA 上诉案件。
Janssen 诉 Celltrion 案(CAFC 18-2321,18-2350)
在地区法院,Janssen 根据等同原则指控 Celltrion 用于生产其Remicade® 生物仿制药的细胞培养基侵犯了第 7,598,083 号美国专利。(17-cv-11008,马萨诸塞联邦地区法院,案卷1 第 12、18-22 页。)Janssen的等同原则理论解释称,被指控的细胞培养基成分范围内“至少存在十二种浓度差异”。(CAFC 18-2321,交叉上诉人的开庭和答辩意见陈述,第 3 页。)2018 年 7 月,地区法院基于 Celltrion 的诱捕抗辩,批准 Celltrion 所提的非侵权即决判决动议。Janssen诉 Celltrion 案,编号17-cv-11008,2018 WL 10910845(马萨诸塞联邦地区法院,2018年 7 月 30 日),维持原判,796F. App’x 741(联邦巡回法院,2020 年)。
在上诉中,Janssen 声称地区法院的分析存在错误,具体表现为 (1) 事后才发现本应很明显的涵盖 Celltrion 细胞培养基的假设性权利要求,而这是不允许的;(2)未发现 Celltrion 关于诱捕的论证缺乏法律依据,在此方面Celltrion 未就选择和修改先有技术参考提供任何动机;以及 (3) 法院在即决判决分析中没有得出有利于Janssen 的合理推论(例如,反向教导使用柠檬酸铁铵作为细胞培养基的成分,以及复制证据)。(CAFC18-2321,上诉人意见陈述,第 2-5 页。)2019 年 2 月,Celltrion 作出回应并提起交叉上诉,声称“Janssen在上诉中的主要论据是狭隘和错误的法律论据”,并且 Janssen 缺乏上诉资格,因为并非 ’083 专利的所有共同所有人都已列为原告。(CAFC18-2321,交叉上诉人的开庭和答辩意见陈述,第 3-7 页。)
2020 年 3 月 5 日,联邦巡回法院发布了规则 36,对地区法院授予的即决判决表示肯定,以Celltrion 胜诉结束了此案。Janssen 诉Celltrion 案,796 F. App’x741 (Mem), 2020 WL 1061676(联邦巡回法院,2020 年)。Celltrion 先前已于 2016 年推出其 Remicade® 生物仿制药Inflectra®。
Amgen 诉 Hospira 案(CAFC 19-1067,19-1102)
2017 年 9 月,陪审团基于Hospira 就 Amgen Epogen®(阿法依泊汀)的生物仿制药侵犯第5,856,298 号美国专利,裁定授予 Amgen 7,000 万美元的合理专利权使用费损害赔偿。(15-cv-00839,特拉华州地区法院。)这是判罚的首例 BPCIA 损害赔偿。到审判时,涉案专利已到期,而在授予损害赔偿时,该生物仿制药既未获批也未上市。陪审团针对制造不属于《美国法典》第35 编第 271(e) 条安全港条款范围内的批次产品,裁定授予损害赔偿。Amgen诉 Hospira 案,336 F. Supp.3d333, 340-45(特拉华州地区法院,2018 年),维持原判,944F.3d 1327(联邦巡回法院,2019 年)。陪审团还裁定,Hospira没有侵犯第 5,756,349 号美国专利。同上,第359-361 页。对于审判后动议,特拉华州地区法院维持了陪审团的裁决。同上,第 344-345、361、366 页。Hospira提起上诉。
2019 年 12 月 16 日,联邦巡回法院作出维持原判的裁决。Amgen 诉 Hospira案,944 F.3d 1327 (联邦巡回法院,2019 年)。对于安全港抗辩,法院认为,陪审团的指示在法律上并无错误。同上,第 1338-1339 页。法院指出,“获得专利的发明是 Amgen 提出权利要求所依据的制造方法”,“被指控的活动是Hospira 使用 Amgen 提出权利要求所依据的制造方法”,因此,“相关调查就不是Hospira 如何使用其制造的各批次产品,而是各项制造行为是否用于与向FDA 提交信息合理相关的用途”。同上。法院还裁定,有实质性证据支持陪审团的裁决,即某些批次不受保护。同上,第1339-1340 页。例如,提交的证据显示,2012 年之后,FDA并未要求 Hospira 制造额外批次。同上,第1340 页。相关但不具决定性的是,Hospira 计划将部分批次“作为商业库存”,尽管Hospira 后来在收到 FDA 的完整回复函后改变了部分批次的名称。同上。
2020 年 1 月 15 日,Hospira 请求就安全港问题重新进行全院联席审理。该请愿书中提出的问题是“当所生产的产品用于生成提交给[FDA] 的信息以寻求批准生物仿制药时,《美国法典》第 35 编第271(e)(1) 条是否提供了安全港,以豁免侵犯主张制造方法权利要求的专利”。(重新全院联席审理请愿书,第1 页。)Hospira 声称,联邦巡回法院合议组的意见与先例相反,认为“为‘制造’药品提供的法定保护[] 对于根据 BPCIA 可主张的大部分专利来说是虚幻的”。(同上,第4 页。)2020 年 2 月27 日,Amgen 回应称,“合议组并未宣布适用于工艺专利的特殊安全港规则”,并且“合议组没有使用‘如何’或‘为什么’表述,而是以法规措辞陈述问题:‘各项制造行为是否用于与向FDA 提交信息合理相关的用途’”。(对重新全院联席审理请愿书的回应,第 2、10 页。)2020 年3 月 16 日,联邦巡回法院驳回 Hospira 重新进行全院联席审理的请愿书,且没有发布关于案情实质的意见。
Genentech 诉 Amgen 案 (CAFC 19-2156)
此上诉案涉及特拉华州地区法院对初步禁令救济的驳回 (18-cv-00924)。此案中被指控的生物仿制药 Kanjinti™(曲妥珠单抗-anns)是以 Herceptin® 为参比产品生产的,该生物仿制药于 2019 年 7 月在地区法院作出裁决后不久上市。在此上诉案中,Genentech 声称地区法院存在错误,具体体现在(1)“基于 Genentech 一直在寻求初步禁令救济而推断Genentech 不会遭受无法弥补的损害,直到 Amgen 决定推出[Kanjinti]”,以及 (2)“采用无条件的绝对规则,即未来活动的许可可抵消当前侵权造成的不可弥补的损害”。(原告上诉人的非保密意见陈述,第25、35 页。)2020 年3 月 6 日,联邦巡回法院发布了规则 36 肯定声明。Genentech 诉 Amgen 案,796 F. App’x 726 (Mem),2020 WL 1081707(联邦巡回法院,2020 年)。如上文所述,在此后不久的 2020 年 7 月,此地区法院诉讼达成和解。
Genentech 诉 Immunex/Amgen 案 (CAFC 19-2155)
此上诉案涉及特拉华州地区法院对初步禁令救济的驳回(上文所述的 19-cv-00602)。此案中被指控的生物仿制药 Mvasi™(贝伐单抗-awwb)是以 Avastin® 为参比产品生产的,该生物仿制药于2019 年 7 月在地区法院作出裁决后不久上市。此上诉案涉及的问题是,Amgen是否需要提供关于 Mvasi™ 补充 BLA 的新商业营销通知。(经更正的非保密原告上诉人开庭意见陈述,第1-3 页。)在地区法院审理以及上诉审理中,Genentech 都声称,尽管Amgen 于 2017 年根据第 262(l)(8)(A)条提供了商业营销通知,但是还必须提供关于各后续补充 BLA 的新通知。(同上,第10-11 页。)Genentech 声称,由于 Amgen 没有提供关于其补充 BLA 的通知,因此,Amgen 应直至提供此等通知的 180 天后,才可对其获 FDA 批准的生物仿制药进行商业营销。(同上,第 12-13 页。)
2020 年 7 月 6 日,联邦巡回法院裁定维持地区法院驳回初步禁令的判决,认为“已经按照第 262(l)(8)(A) 条的要求提供关于其生物制品 [商业营销] 通知的生物仿制药申请人,无需就关于同一生物制品的各补充申请提供其他通知”。Genentech 诉 Immunex 案,964 F.3d 1109, 1112(联邦巡回法院,2020 年)。法院解释道,“法规明确规定,生物仿制药申请人必须在对生物制品进行商业营销之前,向参比产品发起人提供通知”。同上,第1111 页。法院进一步解释道:
Amgen 已于 2017 年10 月 6 日向 Genentech 提供通知,来说明计划对其生物制品进行商业营销。尽管其申请的后续补充增加了一个制造设施并变更了药品标签,但是 Amgen 的生物制品 Mvasi 并未发生改变。因此,早在 2017 年 10 月 6 日,Genentech就已收到 Amgen 根据第 262(l)(8)(A)条提供的关于其计划对 Mvasi 进行商业营销的通知。
同上。
如上文所述,在联邦巡回法院作出裁决后,此地区法院诉讼于 2020 年 7 月 7 日达成和解。
Immunex 诉 山德士 案 (CAFC 20-1037)
此上诉案涉及与山德士的 Enbrel®生物仿制药有关的两项专利。(参见 2-16-cv-01118,新泽西联邦地区法院。)这两项专利最初于1995 年通过专利审查,到期日分别在 2028 年和2029 年。山德士没有对侵权性提出异议,但是根据多种理论对这些专利的有效性提出了质疑。2019 年 8 月 9 日,地区法院作出裁决,认定专利并非无效。Immunex诉山德士案,395 F. Supp.3d 366(新泽西联邦地区法院,2019 年),维持原判,964F.3d 1049(联邦巡回法院,2020 年)。
在上诉案中,山德士对地区法院的明显重复专利认定、书面描述和明显性分析提出了质疑。2020 年 7 月 1 日,联邦巡回法院作出维持原判的裁决。Immunex 诉山德士案,964 F.3d 1049 (联邦巡回法院,2020 年)。具体而言,法院认为,这两项专利并不因为明显重复专利而无效,因为它们并不与其他 Immunex 专利存在共同所有权,涉案专利已转让给了罗氏,Immunex 并未获得“所有实质性权利”。同上,第1057 页。法院认为,Immunex 没有获得“所有实质性权利”是因为罗氏拥有执行专利的次要权利,并且罗氏拥有“否决对Immunex 权益进行任何转让的权利”。同上,第 1061-1062 页。联邦巡回法院还驳回了山德士关于书面描述和明显性的质疑。同上,第 1065-1068 页。
Reyna 法官对此持异议,他认为应基于明显重复专利而判定这些专利无效。同上,第1068 页。Reyna 法官指出,“大多数人允许了其力求防止的花招类型——专利审查中的花招可能会导致专利权的不合理扩展”。同上,第1069 页。具体而言,Reyna 法官解释称,“罗氏……与Immunex 签订……“2004 年和解与清偿协议”,以向Immunex 有效转让涉案专利”,因此,“就明显重复专利而言应认定 Immunex 为共同所有人”。同上,第 1068 页。Reyna 法官“还认为,鉴于 Immunex 先前已根据单向测试获得第7,915,225 号美国专利,Immunex 的涉案专利因明显重复专利而无效”。同上。
2020 年 7 月 31 日,山德士提交了对明显重复专利重新进行全院联席审理的请愿书。该请愿书中提出的问题是“就明显重复专利而言,获得带来专利‘所有实质性权利’(包括控制专利审查的权利)的排他性许可的一方是否应有效成为专利所有人”以及“是否可能仅通过让名义所有人拥有理论上的次要起诉权,而被许可人可通过签发免使用费的转授许可来阻止这种权利成熟,让一方仍然[可以] 避免成为所有实质性权利测试下的有效所有人,从而逃避重复专利审查”。(重新全院联席审理请愿书,第vi 页。)2020 年 9 月 29 日,联邦巡回法院驳回了山德士要求合议组重新审理和重新进行全院联席审理的请愿书,作出有利于Immunex 的裁决并结案。直到 2021 年 3 月,山德士一直在寻求最高法院对此案的审查。
4)联邦巡回法院处理的其他上诉
尽管不是 BPCIA 裁决,但在2020 年作出或待作出的其他几项联邦巡回法院裁决也可能会对生物仿制药产生影响。下面,我们简要地回顾其中一些裁决。
在当前等待联邦巡回法院裁决的 Amgen 诉赛诺菲案 (CAFC 20-1074) 中,法院正在评估针对同属抗体的权利要求的可实施性和书面描述。赛诺菲声称,“无争议的证据表明,要制造和使用全范围的Amgen 功能属权利要求,需要在指挥棒因素下开展过度的实验”,并且“数以百万计的抗体可能处于该权利要求的范围之内”。(经更正的非保密被告上诉人意见陈述,第17-19 页。)2020 年 12 月 9 日通过电话会议举行了口头听证。
在 Biogen MA Inc. 诉 EMD Serono, Inc. 案,976 F.3d 1326(联邦巡回法院,2020 年)案中,联邦巡回法院推翻了地区法院的判决,认为根据多肽的天然形式,法律对于使用重组多肽的治疗方法的权利要求不存在任何预期。法院得出的结论是,“地区法院拒绝考虑重组与天然 IFN-β 的同一性,这与长期以来的规则相悖,即‘旧产品即使采用新工艺制造,也不能获得专利’”。同上,第1332 页。
最后,在 Valeant Pharm.N. Am. LLC 诉 Mylan Pharm.Inc. 案,978 F.3d 1374(联邦巡回法院,2020 年)案中,联邦巡回法院在《药品价格竞争与专利期补偿法案》的背景下处理了审判地问题,特别是在基于审判地提交简化新药申请 (ANDA) 后发生拟制侵权行为的情况下。法院裁定,“在基于《美国法典》第 35 编第 271(e)(2)(A) 条 [根据药品价格竞争与专利期补偿法案]提起的案件中,出于审判地的侵权仅发生在与提交 ANDA 相关的诉讼发生地区,而并非在ANDA 中所述仿制产品的所有未来分销地点发生”。同上,第 1375 页。
反垄断诉讼
如上所述,虽然 2020 年许多生物仿制药已成功进入美国市场并获得重要市场份额,但是也有一些引人关注的例外情况,例如Remicade®(英夫利昔)、Enbrel®(依那西普)和 Humira®(阿达木单抗)生物仿制药。不同生物仿制药的成功差异可能由一系列因素导致,但是已有人提出了一项关切,即主要障碍是参比产品发起人的反竞争行为。例如,最近一项关于生物仿制药制造商和监管机构对知识产权的看法以及生物仿制药简化批准程序的定性研究指出,“生物仿制药的主要知识产权关切……是原研生物制品制造商为其产品获得大量专利,有时称为专利丛”。[8]
在此背景下,许多利益相关者对 Humira®(艾伯维)和 Remicade®(Janssen 和强生 (J&J))的 RPS 提起了反垄断诉讼。下文中将逐一回顾这些诉讼。
Remicade®(英夫利昔)反垄断诉讼
目前,宾夕法尼亚州东区地区法院有多起针对强生 (J&J) 及其子公司 Janssen 的反垄断诉讼,这些诉讼涉及 Remicade®(英夫利昔)。在这些案件中,原告指控 J&J 和 Janssen 实施的一项 Remicade® 保护计划违反了联邦反垄断法,并且通过多种反竞争手段(包括排他性合同、捆绑销售和强制回扣)维持Remicade® 的市场份额和价格。
首个案件由辉瑞提起(编号 17-cv-04180,宾夕法尼亚东区联邦地区法院),而由间接购买者提起的后续集体诉讼(编号 17-cv-04326,宾夕法尼亚东区联邦地区法院)正处于事实证据开示阶段,但是因受新冠疫情的影响而延迟进行。Walgreen 和 Kroger 案(编号 18-cv-02357,宾夕法尼亚东区联邦地区法院)处于早期阶段,地区法院最初裁定原告由于合同限制缺乏资格,但第三巡回上诉法院于 2020 年 2 月推翻了该裁决。Walgreen Co. 诉强生案,950 F.3d 195, 196(第三巡回上诉法院,2020 年)(推翻地区法院的裁决,因为“反垄断主张基于联邦法规,因此属于商业协议的外在权利,而不是‘根据’商业协议获得的权利”。)2020年 4 月 6 日,强生和Janssen 在 Walgreen 和 Kroger 诉讼中提交答辩状。值得注意的是,2020 年 10 月 20 日,Rochester Drug Co-operative,Inc. 在直接购买者诉讼(编号 18-cv-00303,宾夕法尼亚东区联邦地区法院)中提交了自愿撤诉协议书。
关于:Humira(阿达木单抗)反垄断诉讼,编号 19-cv-1873(伊利诺伊北区联邦地区法院)
2019 年 3 月,艾伯维的拳头生物制品Humira®(阿达木单抗)的间接购买者在伊利诺伊北区联邦地区法院针对艾伯维和Humira® 生物仿制药制造商提起反垄断诉讼。(19-cv-01873,伊利诺伊北区联邦地区法院)。诉状提出两种反垄断理论作为诉因。第一,原告指出,艾伯维围绕 Humira®构建了一个“无效、不可执行或非侵权专利”的“专利丛”,阻止了阿达木单抗生物仿制产品进入市场,造成市场垄断,从而违反了《谢尔曼法案》的第2 条规定。第二,原告进一步指出,艾伯维和若干 Humira® 生物仿制药制造商签订了反竞争性的“有偿延迟”和地理市场分配和解协议,违反了《谢尔曼法案》的第 1 条规定。
2020 年 6 月,美国地区法院法官Manish Shah 驳回了诉状但保留了再诉权利,裁定原告的指控既没有针对可认定的反垄断违法行为,也未提出反垄断损害。(案卷170。)法院得出的结论是,“绝大多数被指控的计划都已获得反垄断审查豁免 [例如,根据诺尔-本灵顿原则],只剩下了一些对参与受监管专利和生物类药品机制的成熟竞争对手的尖锐抨击”。(同上,第31 页。)此外,艾伯维的和解协议并不符合最高法院在 FTC 诉Actavis 案裁决中认定为非法的“反向支付”和解模式,例如,因为“和解……允许提早 [进入美国市场] 而不支付”。(同上,第 43 页。)并且,此外,法院裁定,原告的反垄断损害指控“过于投机”。(同上,第 51 页。)
原告向第七巡回上诉法院提起上诉 (20-2402)。上诉人于 2021 年 2 月1 日提交了回复简报,完成了意见陈述。还已提交了来自利益相关方的若干法庭之友意见陈述,包括贸易组织、公共利益团体,以及经济学、法学、商务和医学教授。口头听证预定于2021 年 2 月 25 日举行。
专利审判与上诉委员会 (PTAB) 受理的授权后挑战
在专利审判与上诉委员会 (PTAB),2020 年是生物制品和生物仿制药业较为平静的一年。2020 年仅提交了两份生物制品多方复审 (IPR) 请愿书,与2017 年超过 80 份相比,呈显著下降态势。
2020 年 1 月 3 日,Regeneron 提交了针对 Kymab 的 IPR 请愿书,该请愿涉及的专利权利要求是,产生具有人类可变结构域和小鼠恒定结构域的“反向嵌合”抗原特异性抗体的转基因小鼠。(IPR2020-00389,文件 2 第 1 页。)PTAB于 2020 年 5 月26 日拒绝立案。(文件 7。)Regeneron 之前曾于 2019 年提交了四份其他 IPR 请愿书,对与被改造以产生抗体的转基因小鼠相关的其他 Kymab 专利提出质疑,但同样均受到PTAB 的否决。(同上,第 2 页。)
PTAB 在 12 月收到了一份针对Amgen 生物法专利的 IPR。此外,PTAB 还于 12 月收到了一份针对 SeaGen, Inc. 与 Enhertu(曲妥珠单抗-deruxtecan)相关的授权后复审 (PGR) 申请。这两项申请目前仍处于待决状态。
虽然 2020 年收到的生物制品IPR 申请并不多,但是有几项争议在去年得到了解决,下面列出了其中一部分。
- Cosentyx®(苏金单抗):2020 年 2 月,Novimmune 与 UCB 在 PTAB 立案前就两项关于 Novimmune Cosentyx®(苏金单抗)成分和治疗方法权利要求的 IPR 达成了和解。(IPR2019-01480、IPR2019-01481。)
- Emgality®(加那珠单抗):2020 年 2 月和 3 月,PTAB 宣布 Teva 就 Eli Lilly 的 Emgality®(加那珠单抗)向其提出的六项专利权利要求主张无效(IPR2018-01422、IPR2018-01423、IPR2018-01424、IPR2018-01425、IPR2018-01426、IPR2018-01427),并认定其他三项专利的权利要求有效。(IPR2018-01710、IPR2018-01711、IPR2018-01712。)
- Soliris®(依库丽单抗):2020 年 5 月,Amgen 与 Alexion 在 PTAB 立案后就三项关于 Alexion Soliris®(依库丽单抗)成分和治疗方法权利要求的 IPR 达成了和解。(IPR2019-00739、IPR2019-00740、IPR2019-00741。)Amgen 获得了一项非排他性、免使用费的美国许可,并能够在 2025 年 3 月向市场推出一款生物仿制药。
- Amgen 制造专利:2020 年 6 月,Amgen 与 Fresenius 就关于两项 Amgen 制造专利的 IPR 达成了和解。双方在 PTAB 立案前就 Fresenius 质疑与蛋白质折叠方法相关的 Amgen 专利的 IPR (IPR2020-00314) 达成了和解,并且双方还在 PTAB 立案后就 Fresenius 质疑与蛋白质纯化方法相关的 Amgen 专利的 IPR 达成了和解。(IPR2019-01183。)
此外,联邦巡回法院在 2020 年对涉及生物制品的多项IPR 上诉进行了衡量,并在其中许多案件中,对 PTAB 裁定权利要求无效的最终书面裁决予以肯定。例如:
- Genentech 诉 Hospira, Inc. 案,946 F.3d 1333(联邦巡回法院,2020 年)(对裁定抗体制造权利要求如预期且明显无效的 IPR 裁决予以肯定,并认定导致《美国发明法案》颁布之前发布的专利无效的 IPR 追溯性应用,并不违反美国宪法第五修正案的征用条款);
- Immunex Corp. 诉 Sanofi-Aventis U.S. LLC 案,977 F.3d 1212(联邦巡回法院,2020 年)(对裁定结合人类 IL-4 受体的分离人类抗体权利要求明显无效的 IPR 裁决予以肯定);
- Genentech 诉 Iancu 案,809 F. App’x 781(联邦巡回法院,2020 年)(对裁定使用抗 ErbB2 抗体的治疗方法权利要求无效的 IPR 裁决予以肯定);
- AbbVie Biotechnology, Ltd. 诉美国政府案,789 F. App’x 879(联邦巡回法院,2020 年)(对裁定三项针对阿达木单抗的专利明显性无效的 IPR 裁决发布规则 36 肯定声明);以及
- Biogen, Inc. 诉 Iancu 案,831 F. App’x 506, 507(联邦巡回法院,2020 年)(对裁定涉及利妥昔单抗的治疗方法权利要求无效的 IPR 裁决发布规则 36 肯定声明)。
结 语
2020 年几乎没有新的生物仿制药批准,与生物仿制药相关的诉讼也有所减少。虽然此减少可能部分由全球新冠疫情导致,但是这也可能代表了对已有几十年历史的生物制品的第一阶段挑战与对即将结束十二年法定专营保护期的较新生物制品的预期第二阶段挑战之间的间歇期,并且胰岛素和其他生物制品现已视为作为BLA 寻求批准。
尽管批准和诉讼数量减少,但是美国生物仿制药市场持续增长,2020 年有五种新的生物仿制产品上市,且报告表明生物仿制药的市场吸纳量有所增加。FDA 仍是该领域的积极参与者,促进胰岛素和其他“药品”转变为在生物制品法定框架下接受监管,并就生物仿制性、可互换性、宣传标签和广告等若干不同问题提供新的指导。联邦和州立法者也继续考虑立法,以提高患者可及性、降低药品价格并促进竞争。
2021 年,美国生物仿制药业可能会迎来多项新发展。FDA 目前正在审查针对尚无已获批生物仿制药的参比产品的生物仿制药 BLA,例如Samsung Bioepis 和 Biogen 的 SB11,这是一种参照 Lucentis®(兰尼单抗)所生产的生物仿制药。可互换胰岛素也将问世,例如Semglee™。此外,Amgen 已宣布,新获批的 Riabni™(利妥昔单抗-arrx)将于 2021 年初在美国上市。在诉讼方面,第七巡回上诉法院将可能提供有关艾伯维因其拳头生物制品Humira® 而遭受反垄断指控的深入见解,而待决和未来的地区法院 BPCIA 诉讼中也可能会提供更多指导。






