
何小萍 | 日本医药知识产权的保护及实践工作的注意点

金秋十月,硕果累累,在众多医药知识产权界专家、IPR、律师朋友的关心与支持下,第八届知产前沿医药论坛于2023年10月20日在上海龙之梦大酒店圆满闭幕。本次大会吸引了线上与线下、海内外近800位生物医药IP人士参加,现场交流互动热烈。
在10月18日的会前研讨会上,礼来公司副总裁助理、亚太地区知识产权负责人何小萍博士为本次大会带来“日本医药知识产权的保护及实践工作的注意点”。知产前沿现将何博士的现场主题发言内容整理成文,供知识产权业内人士参考学习。
如需购买第八届知产前沿医药论坛直播回顾,请点击文末“阅读原文”(购买3天全程直播优惠价格为2666元);如需开具发票,请添加工作人员Sharon:chanying_930。
目次
一、创新医药的知识产权保护
(一)知识产权保护决定创新药的生命周期
(二)创新医药的专利保护
(三)创新医药的专利期补偿
(四)创新医药的数据独占期
二、日本医药行业的概况
(一)日本医药品销售市场的概况
(二)日本制药工业的概况
(三)日本的医药专利保护期延长制度
三、日本的主要医药知识产权相关政策
(一)日本的主要医药知识产权相关政策
(二)日本的新药再审查制度
(三)日本的医药专利保护期延长制度
(四)日本的类专利链接制度
四、日本医药专利实践工作的注意点
(一)物质专利写法的医药用途发明
(二)日本药品专利保护的概要
一、创新医药的知识产权保护
(一)知识产权保护决定创新药的生命周期
知识产权保护决定了创新药的生命周期。创新医药是在数万个候选药品中经过包括5-10年临床试验期的漫长的研发,才能最终获批上市。即便获批后,成为成熟的药品前,还有缓慢的增长过程,在医药专利生命周期的中后段才能为公司带来收益。创新药的知识产权保护与创新药生命周期的关系是,因为创新药的核心专利在研发的早起阶段申请,而大多数情况只有在专利的20年保护期的中后期所保护的创新药才能够被批准上市。所以多数国家都会为创新医药设置特殊的保护制度。例如我国2021年专利法改革的专利期补偿制度,以及为保护安全性有效性的药品实验数据保护制度(药监局职权范畴),和在仿制药进入市场前的专利链接(药品专利早期解决纠纷机制)。
(二)创新医药的专利保护
创新药的专利发明可能贯穿研发全阶段,涵盖全部专利类型。医药品的特殊性除了研发过程很长之外,还关系到人体生命健康问题,研发费用也很高。从基础研究、药物探索到临床前研究,就大概花费3-6年,例如对数万个候选品中进行筛选,在动物实验研究之后的人体临床试验也可能要5-10年甚至更长。据美国研究制药工业协会的报道,2013年一个产品的最终上市平均就需要23亿美元。只有在有效的专利保护下才能支持医药企业进行持续的创新,保障创新药企业进行进一步的研发。
在专利布局过程中,一般最早期申请的是核心的物质专利,可能是药物探索或者临床前研究阶段。在核心物质专利申请后可能还会有进一步的后期创新专利,例如临床前动物实验,可能会发现原本目标疾病之外的医药用途可以申请,或者在人体临床开始时可以设计专门针对人体的制剂、结晶的专利,都属于后期创新专利。人体临床实验中对特定疾病的特定用法用量、特定适应症、进行大量生产后的制备专利等。到了上市后可能发现新问题,例如新型减轻疼痛的注射剂、缓释制剂专利等。或者A药与B药联合使用可以起更好的效果,也能够申请专利。
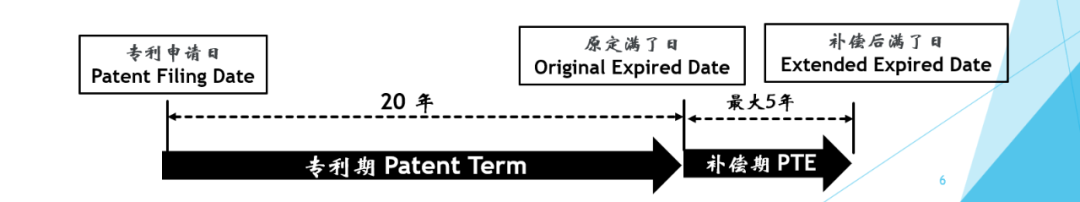
(三)创新医药的专利期补偿
专利权的期限一般为20年。作为对获得监管部门批准所花费时间的补偿,很多国家对批准上市的药品的专利可以授予最长5年的专利期补偿。不同的国家有不同的上市后独占期的上限。

(四)创新医药的数据独占期
很多鼓励创新的国家除了专利期补偿之外还设置有鼓励创新医药的试验数据保护制度,即对创新药的临床或前临床的试验数据授予独占权的一种数据保护制度。我国目前虽还暂时未正式实施试验数据保护制度,但最近几年有了很多对创新药试验数据独占期的讨论和意见, 还在2018年出台过一个中国数据独占期的草案。
二、日本医药行业的概况
(一)日本医药品销售市场的概况
日本为2022年世界第三医药品销售市场,占据了重要地位。虽然中国的市场份额已超过了日本,但是日本的医药品市场份额一直以来都是处于世界前三位。日本行使的是全民国家医疗保险制度。
(二)日本制药工业的概况
根据2023全球制药企业50强信息,日本企业数位居国家排名第二,在50强中有6家日本企业。
(三)日本制药行业发展回顾
在1980年代,尽管在汽车或电子产品等行业,日本已发展具有全球领先的竞争实力,但在制药行业,当时的日本却是先端创新医药品的净进口国,几乎没有全球重磅销售医药品,相关产品主要来自于欧美国家。
进入1990年代后,日本政府对医药行业进行了包括知识产权相关政策在内的一系列改革,并向外国竞争对手开放了日本市场。改革极大地促进和鼓励了日本制药业的全球化以及日本制药公司的创新。这些政策包括了,取消外企的销售限制、医药品进口税的优惠、减短医药品审批的时间、非关税壁垒、创新药的定价扶持等改革政策。
三、日本的主要医药知识产权相关政策
(一)日本的主要医药知识产权相关政策
日本新药再审查制度⇒相当于欧美的数据保护制度;
日本医药专利保护期延长制度⇒相当于中国的专利期补偿制度;
日本仿制药上市前专利争议解决方法⇒相当于专利链接制度。
(二)日本的新药再审查制度
1、新药再审查制度源自《日本医药医疗器械法》第14条之4。
再审查制度是指,在新药上市后的特定时期内,生产和销售许可持有人(MAH),必须对新药进行上市后调查,以便由厚生劳动省(MHLW)进行再审查,以再次确认新药的有效性和安全性的一种制度。再审查的审查对象包括新的活性成分、给量方法、适应症、含量等。
2、日本的再审查期间实质上相当于数据保护期间:
(1)在新药再审查期间结束之前,仿制药不能提交上市申请.
(2)日本的再审查制度实质上起到了保护新药的作用。所要求的再审查期间实质上就相当于安全性和有效性数据的独占保护期。
3、新药再审查的期间
不同的新药种类对应不同的再审查期间。

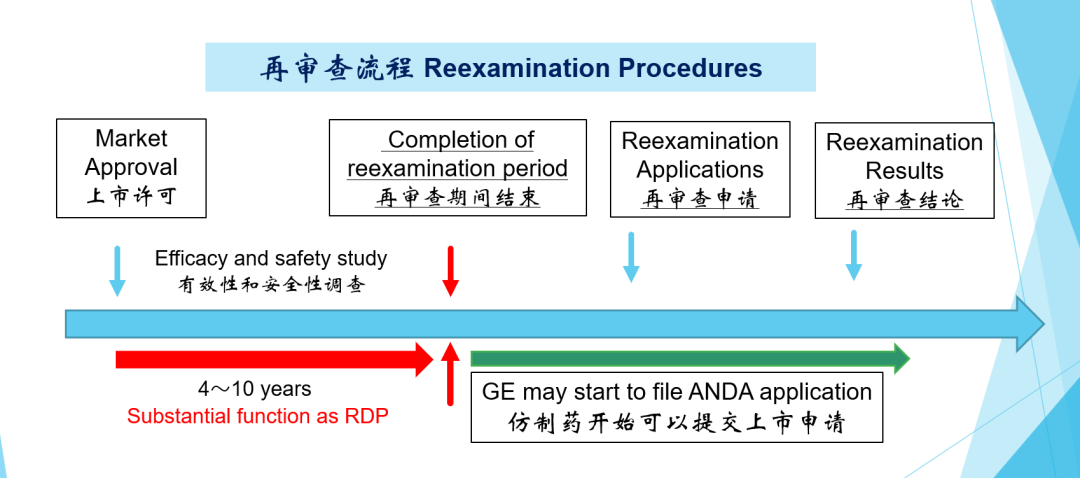
4、再审查流程
一般的新药上市许可之后,有4-10年再审查期间,在此再审查期间过后, 生产和销售许可持有人会向日本厚生劳动省提交再审查申请,进入再审查阶段,之后获取再审查结论。
(三)日本的医药专利保护期延长制度
1、医药专利保护期延长制度源自日本特许法第67条第1及2款。
一般专利保护期为自专利申请之日起20年,但由于药事法要求医药制品必须获得政府的上市许可,使得药品专利实际获得的有效保护期通常少于20年。为了鼓励医药品的创新,药品专利保护期可以依据为获得该药品上市许可所损失的上市时间而延长。专利权的延长期限最长不超过5年。
日本专利保护期延长制度存在的特色有:
1、所有由于药事法规要求而无法实施的日本发明专利都可以申请专利保护期的延长。没有对发明类型的限制,也没有对申请延长专利数量的限制。
2、日本专利权保护期的延长期限最长不超过5年,但没有美国欧洲所规定的上市后合计14或15年的独占期的限制。
3、日本专利保护期的延长必须基于针对“首次”上市许可,只要是不同适应症的后续上市许可等都可属于“首次”上市许可,都可以由此申请专利的延长。
4、延长期限的计算是从:
(1)临床试验申请提交日或;
(2)专利授权日的,较晚的时点起算至;
(3)上市许可日为止的期限。
(四)日本的类专利链接制度
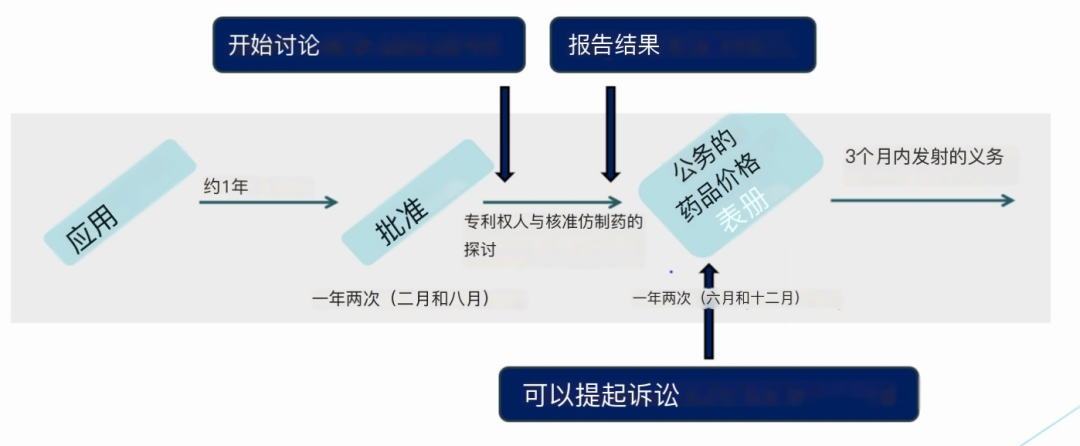
日本的类专利链接制度遵循两步骤的构架:
(1)步骤1:基于原发药专利信息决定的仿制药上市许可。在物质或用途专利过期之前, 厚生劳动省不会批准仿制药上市,与中国的链接诉讼不同。
(2)步骤2:在进入价格清单前的原发药与仿制药之间的事前协商。在获得仿制药的上市许可之后,进入价格清单之前,仿制药公司应该和拥有其他类型有效专利的原发药公司(例如制剂,多晶型或生产方法专利等)协商解决上市之前的任何潜在专利侵权问题)。日本的价格清单类似于中国的医保目录。所有厚生劳动省批准上市的医药品都可以申请并自动进入,但医药品的价格综合各方面考虑因素而制度。
四、日本医药专利实践工作的注意点
(一)物质专利写法的医药用途发明
中国的用途需要写成“瑞士”写法。但日本可以使用物质专利写法保护医药用途发明,新用途的限定可以被认定为具有新颖性。另外,日本也可以申请用法用量专利,新用法用量的限定也可以被认定为有新颖性。
1、医药用途发明的新颖性:当要求保护的药物发明和引证的现有技术发明相比,在基于特定疾病的药物用途不同时,其要求保护的药物发明也具有新颖性。例如,权利要求1:一种治疗阿尔茨海默病的药物,含有化合物A作为其有效成分。在化合物A治疗阿尔茨海默病具有新颖性时,该权利要求1则具有新颖性。
2、医药用法用量发明的新颖性:当要求保护的药物发明和引证的现有技术发明相比,在以特定剂量或给药方式的医药用途上存在差异时,该要求保护的医药发明具有新颖性。举例如,权利要求1:一种含有化合物A的抗哮喘药物,其特征为患者每三个月口服用药一次,其中化合物A的用药量为30至40μg/kg体重的量。在化合物A的用药量为30至40μg/kg体重的量具有新颖性时,该权利要求1则具有新颖性。
(二)日本药品专利保护的概要
日本可以授予专利的概要如下。手术治疗和诊断方法不允许授予专利,但许多以下方面的创新都可以授权。

作者:何小萍
编辑:Eleven



